El modelo cinético molecular en sus inicios se desarrollo para los gases, sin embargo se puede aplicar a los tres estados de la materia.
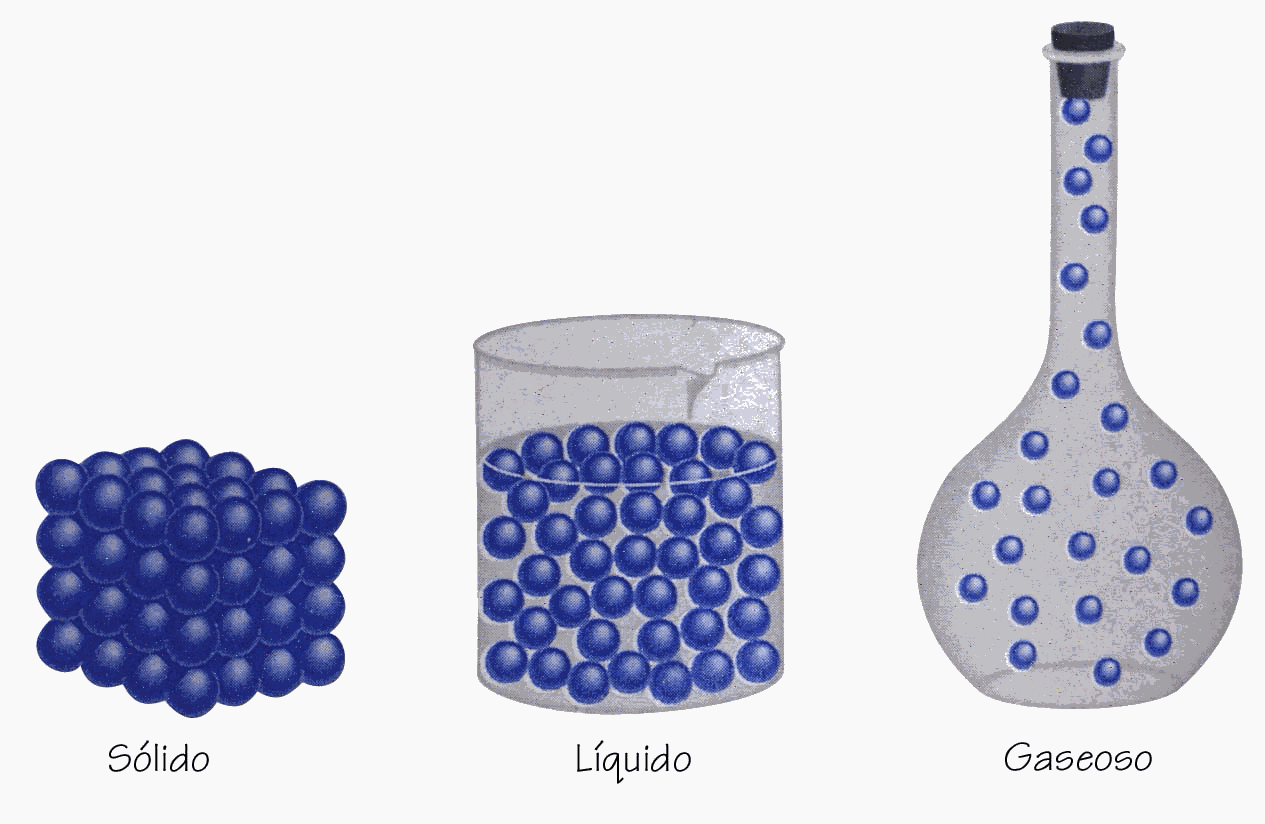
· Estado sólido: las moléculas están muy juntas y se mueven oscilando alrededor de posiciones fijas. En el estado sólido las fuerzas de cohesión son muy grandes.
· Estado líquido: las moléculas están más separadas y se mueven de manera que pueden cambiar sus posiciones, pero las fuerzas de cohesión, aunque son menos intensas que en el estado sólido, impiden que las moléculas puedan independizarse.
· Estado gaseoso: las moléculas están totalmente separadas unas de otras y se mueven libremente; no existen fuerzas de cohesión.
La intervención de la temperatura en la teoría cinética de la materia.
Cuando aumentamos la temperatura de un estado sólido, sus moléculas se moverán más rápidamente y aumentara la distancia entre ellas. Las fuerzas de cohesión disminuyen y llegará un momento en que éstas fuerzas son incapaces de mantener a las moléculas fijas, así las moléculas pueden desplazarse, el estado sólido entonces se va a convertir en un liquido.
Si aumenta la temperatura de un líquido, sus moléculas aumentara su rapidez, la distancia entre ellas irá aumentando y las fuerzas de cohesión van disminuyendo hasta que finalmente las moléculas pueden liberarse unas de otras, y así este conjunto de moléculas se convertirá en estado gaseoso.
Si se disminuye la temperatura de un estado gaseoso, disminuye la rapidez de sus moléculas y así unas a las otras se acercan, esto para que sus fuerzas de cohesión, que siempre aumentan al disminuir la distancia, puedan mantenerlas unidas, así pasará a estado líquido.
Si se disminuye aún más la temperatura, se moverán más lentamente las moléculas, así que la distancia entre ellas seguirá disminuyendo, las fuerzas de cohesión aumentarán más y llegará un momento que son lo suficientemente intensas como para impedir que las moléculas puedan desplazarse, obligándolas a ocupar posiciones fijas, así se ha convierte en estado sólido.
La teoría cinética molecular describe las propiedades y el comportamiento de los gases. Todos los gases están formados por moléculas que se encuentran en movimiento continuo, es rápido, rectilíneo y aleatorio. Las moléculas de los gases están muy separadas entre sí y no ejercen fuerzas sobre otras moléculas. Las hipótesis que fundamentan el comportamiento de este modelo son:
· El gas está formado por un conjunto de N(~1022) moléculas concebidas por pequeñas esferas rígidas de diámetro (aproximadamente 10-8 cm), despreciable comparado con longitudes macroscópicas. Nótese que el volumen ocupado por una molécula es aproximadamente igual a 10-24 cm3. De aquí que ocupado por 1022 moléculas sea apenas de l0-2 cm3: ¡la centésima parte de un cm3! Por tanto, en nuestro recipiente de 1 000 cm3 prácticamente todo el espacio está vacío.
· En ausencia de fuerzas externas y despreciando los efectos del campo gravitacional, las moléculas están distribuidas uniformemente en el recipiente. Esto es, en todo momento número de moléculas por unidad de volumen es constante.
· Las moléculas no ejercen fuerzas entre sí, excepto cuando sufren una colisión con otra molécula o contra las paredes del recipiente. Además, estas colisiones son elásticas.
· Todas las direcciones de las velocidades moleculares son igualmente probables.
· Las magnitudes de las velocidades moleculares cambian constantemente como consecuencia de los choques y, numéricamente, pueden tomar valores entre cero y una velocidad máxima que no puede exceder la velocidad de la luz.

En el siguiente video, se ilustra la composición de un gas y los choques entre sus moléculas.

me parece muy agradable que hayan puesto vídeos imágenes y las ecuaciones es decir utilizaron medios didácticos y faciles de manipular para que la informacion que muestran en su blog que por cierto es ta muy bien redactada resumida y explicada sea mejor comprendida por nosotros me gusto ademas de que su blog esta muy presentable :) mucha suetrte compañeras les dese muchos exito !!!!!!!!
ResponderEliminar